Estructura 2.2 El modelo covalente
Qué determina la naturaleza y las propiedades covalentes de una sustancia?
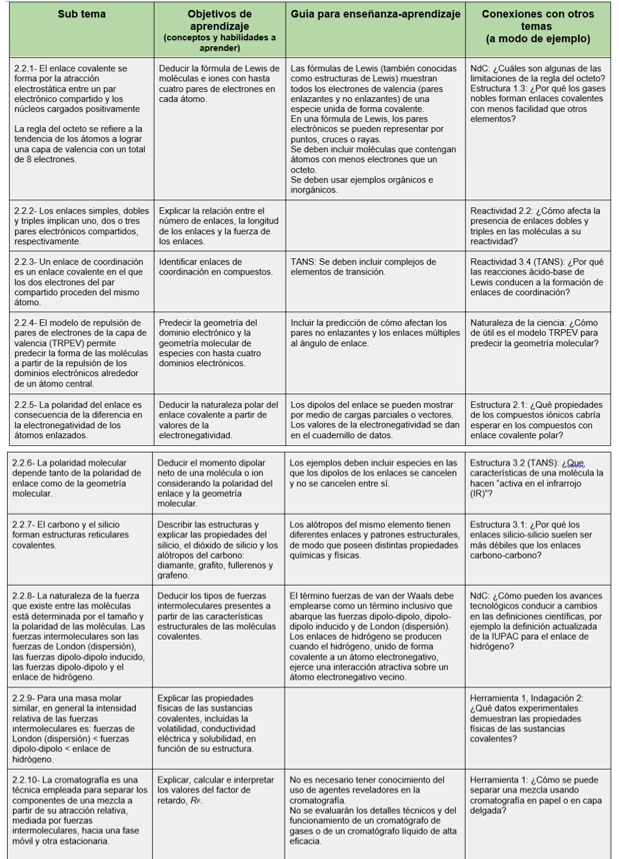
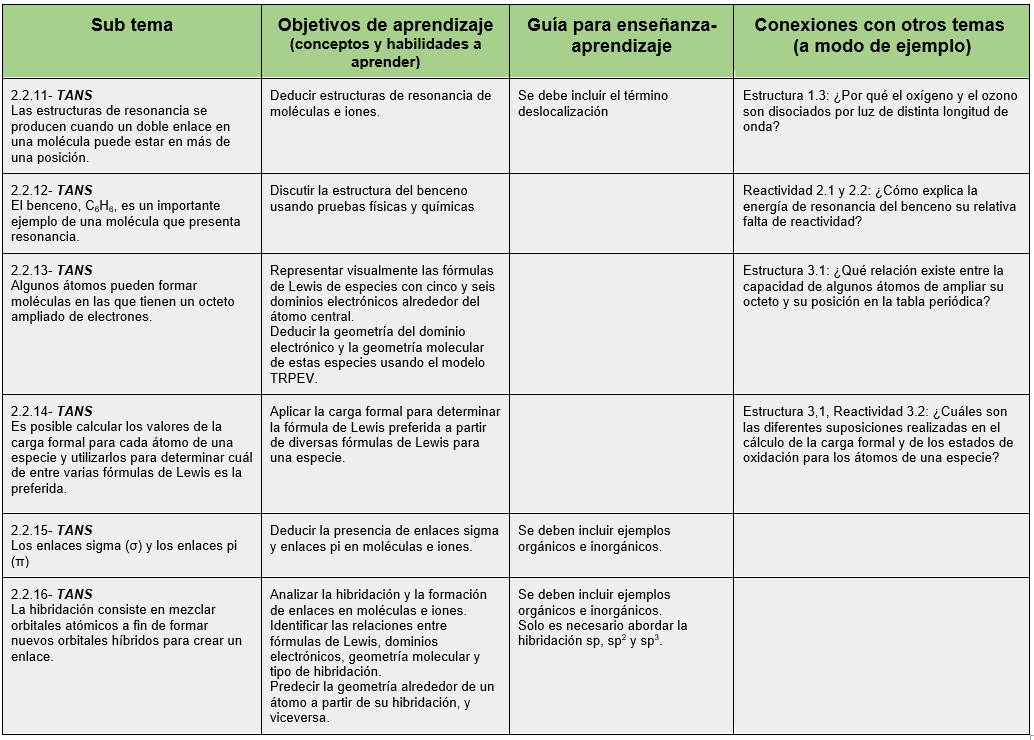
El siguiente cuadro muestra los conceptos y habilidades a aprender en este tema.
Deslocalización electrónica
Distribución de electrones que no están asociados a un solo enlace o átomo, sino extendidos sobre varios átomos. En sistemas covalentes se observa, por ejemplo, en estructuras con resonancia.
Electronegatividad
Medida de la capacidad de un átomo para atraer hacia sí los electrones compartidos. Determina el grado de polaridad del enlace covalente.
Energía de enlace
Energía necesaria para romper un enlace covalente específico en fase gaseosa. Se usa como medida de la fortaleza del enlace.
Enlace coordinado (dativo)
Enlace covalente en el que ambos electrones del par compartido provienen del mismo átomo. Tras formarse, es equivalente a un enlace covalente convencional.
Enlace covalente
Enlace químico formado por la compartición de uno o más pares de electrones de valencia entre átomos (generalmente no metálicos), lo que genera moléculas discretas o redes covalentes.
Enlace covalente no polar
Enlace covalente con compartición de electrones aproximadamente equitativa, cuando las electronegatividades son iguales o muy similares.
Enlace covalente polar
Enlace covalente con compartición desigual de electrones por diferencia de electronegatividad; genera cargas parciales δ+ y δ−.
Enlace pi (π)
Enlace covalente por solapamiento lateral de orbitales (usualmente p) por encima y por debajo del eje internuclear. Aparece en enlaces dobles y triples y restringe la rotación.
Enlace sigma (σ)
Enlace covalente por solapamiento frontal de orbitales a lo largo del eje internuclear. Es el primer enlace que se forma entre dos átomos.
Geometría molecular
Disposición tridimensional de los átomos en una molécula, determinada por la repulsión entre pares de electrones (modelo TRPEV).
Hibridación
Modelo que combina orbitales atómicos para formar orbitales híbridos (sp, sp2, sp3) que explican geometrías y ángulos de enlace observados.
Longitud de enlace
Distancia promedio entre núcleos de dos átomos enlazados covalentemente. Disminuye típicamente al aumentar el orden de enlace (triple < doble < simple).
Momento dipolar
Magnitud vectorial que representa la separación de cargas en un enlace o en una molécula. Depende de la polaridad de los enlaces y de la geometría molecular.
Orbital molecular
Región de probabilidad electrónica en una molécula resultante de la combinación de orbitales atómicos; puede ser enlazante, antienlazante o no enlazante.
Par de electrones compartido
Par de electrones de valencia compartido por dos átomos y localizado en la región internuclear, responsable de la unión covalente.
Polaridad molecular
Resultado de la suma vectorial de los momentos dipolares de enlace; una molécula puede ser globalmente no polar aun con enlaces polares si su geometría es simétrica.
Red covalente
Estructura extendida en la que los átomos están unidos mediante enlaces covalentes en una red tridimensional continua (p. ej., diamante, SiO2).
Resonancia
Representación de moléculas covalentes cuya estructura electrónica no se describe con una única estructura de Lewis. La molécula real se considera un híbrido de resonancia con densidad electrónica deslocalizada.
TRPEV (Repulsión de Pares de Electrones de la Capa de Valencia)
Modelo que predice la forma molecular asumiendo que los pares de electrones se repelen y se disponen para minimizar dichas repulsiones.

